118号 SUMMER 目次を見る
■目 次
■臨床検討会を振り返って
私にとって昨年は、海外での講習会で本当の意味での我レーザーと共に戦えりという状況でした。自国製の器械を持って、海外で仕事ができるということはとても誇りに感じました。タイでは、Lezawin(炭酸ガス)・Er:YAG(Adverl)と、二つのレーザーをテーマに数回講習会を行いました。UAEでは、UAEにおける学会でのEr:YAGの発表、講習会、診療室でのレーザー治療のデモと、レーザーに関して幅広い活動をしました。両国においても、講習会はすべて日本と同じ内容で行いました。その中で、レーザーを真剣に自費にて診療で使用することは、かなり高いスキルが必要であるということが強く認識させられました。またレーザーに対しての考え方も日本とは大きく違い、なんにでも応用というわが国と異なり、何に対してこの機械(レーザー)はできるのか、またそれに対してのエビデンスを強く要求されました(写真1~4)。
私は、臨床検討会を、昨年の2005年4月17日(新潟)からはじめ、今年の4月で計26回日本各地で行ったことになります。
臨床検討会では、開催日前に先生方にアンケートを送らせて頂き、現在のレーザーの使用状況と、臨床上での問題点・質問等を記載して頂いています。当日は、スライドや豚の顎骨を使用して、レーザー使用の際の疑問点などを中心に皆さんと一緒に考えてきました。
開催が10回目を越えていくと、皆さん方の質問の内容が似たようなものになってきたのには驚きました。
今回は質問の中から、特に多かったものに対してお話していきたいと思います。読まれている先生方で自分が出した質問だというのがあるかもしれません。臨床でレーザーを使用している時の疑問は、のどに刺さった魚のとげのように気になるものです。

写真1
写真2
写真3
写真4
前回は高パルスの臨床を書かせて頂きましたが、初期のAdverlを購入された先生からは「なぜ高パルスなのか?」ということで多くの質問が寄せられました。
①アドベールに於ける“高パルスモード”搭載の意義は何か?
特に軟組織の切開を容易にすることができます。手を動かすスピードに切開するためのレーザーパルスの繰り返しが追いつかないと、連続的な切開が困難ですが高パルス化することにより、手を動かすスピードに対して、単位長さを切開するためのレーザーパルス数を相対的に増やすことができ、スムーズな切開が可能となります。
また、硬組織においても、象牙質に関してはパルス数に応じた切削量となるので、硬組織の切削の高効率化にも効果があります。ただし、エナメル質に関しては、その切削量は1ショット当たりのエネルギーとの相関が強く、低パルスでもmJを上昇させることで対応できます。
高パルス照射時での組織に対する影響は、ビーグル犬を用いた動物実験などでも、低パルスのものに比べて特に変わった組織障害は硬組織、軟組織とも出ていません。当然高パルス化されたものは、同じmJに比べて単位時間当たりの総エネルギーが大きくなりますので、注水などによる冷却を十分に行う必要があります。
②高パルス照射時の臨床評価は如何なるものか?
例えば、10pps×100mJと20pps×50mJの場合、明らかに照射面の組織反応が異なります。10pps×100mJと20pps×50mJと単位時間当たりの総エネルギーは同じですが、例えば組織の蒸散閾値が70mJの部分があれば、前者の照射条件では蒸散が起こり、後者の照射条件では蒸散が起こらず、エネルギーが蓄積されるからです。
また、蒸散の閾値をまたいでいない場合でも、注水が高パルスの短いパスル間欠時間に十分行き渡らない場合には照射面は違った反応になります(写真5)
③何故、高パルスモードが必要と考えるか?
前述したように、軟組織のスムーズな切開と蒸散の閾値の差を利用した選択的蒸散を高効率で行える可能性があるためです(写真6)。
④照射時の注水量について?
a:応用症例と照射時の注水量の関係は?症例に関しましては、今までと何も変わりませんが、軟組織においての切除効率は上がります。
チップにおいては、S600TだけではなくC400Fでも切除が可能となりました。注水量は今までと変化はありませんが、疼痛管理となると、非麻酔下では注水したほうが、痛みのコントロールは容易です。
インプラント周囲においても、注水下での使用が望ましいです(写真7)。
メラニン除去は、10ppsでは非注水で行いましたが、高パルスになり20pps40mJでの注水下で斜めそぎおとす照射法に痛みの改善と効率を上げるため大きく変化しました(写真8~10)。
b:照射時は発熱の低減以外の効果は如何なるものか?患部のイリゲーション、と硬組織の切削効率の確保。硬組織の切削のメカニズムは、ハイドロキシアパタイトに含まれる水酸基に反応するためといわれていますが、Er:YAGレーザー照射で十分に蒸散しきれなかったアパタイトは水酸基のみが蒸散し、アパタイトの中には水酸基が乏しくなっており、そのような状態の硬組織の蒸散を維持するためには、外部からEr:YAGレーザーに反応する水を補う必要があります。
アパタイトの表面やポーラスな部分に染み込んだ水はEr:YAGレーザーを特異的に吸収して、そのマイクロエクスプロージョンのエネルギーで周囲のアパタイトを破砕し、それが連続的な切削に寄与していると考えられています。
また、臨床に入る前にこのような質問がありました。
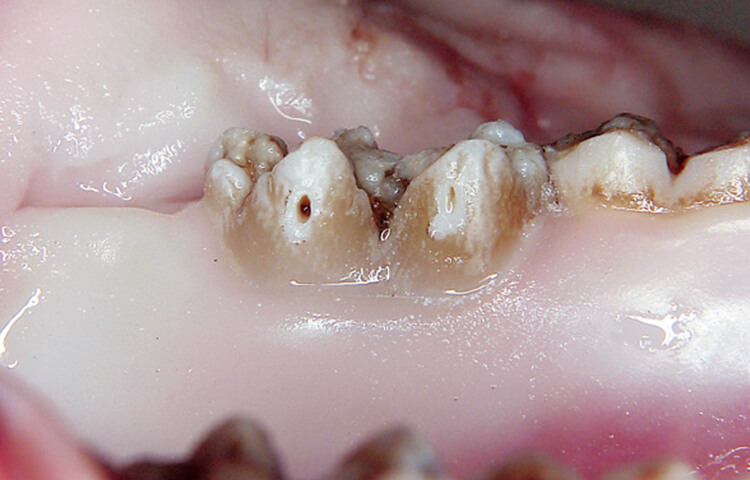
写真5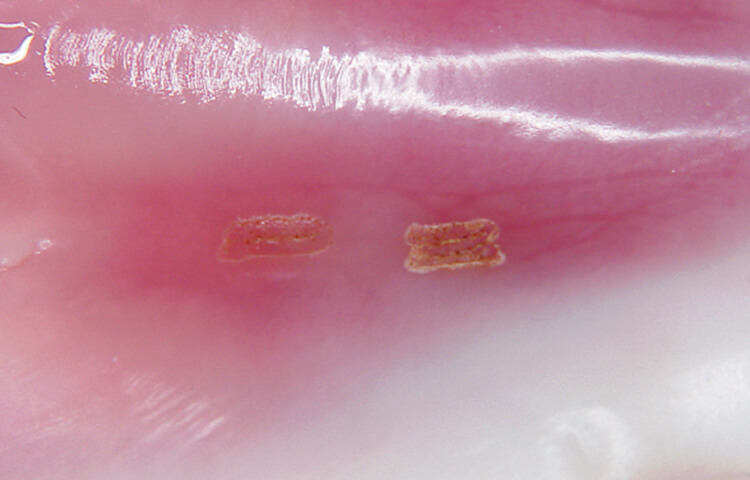
写真6
写真7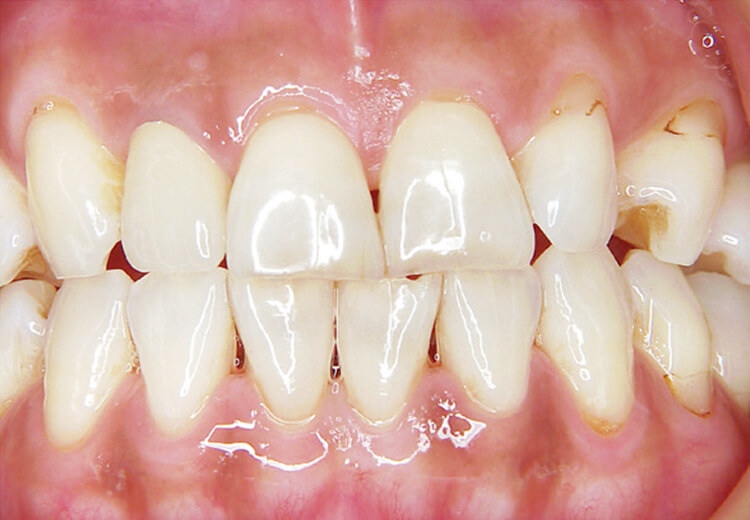
写真8 術前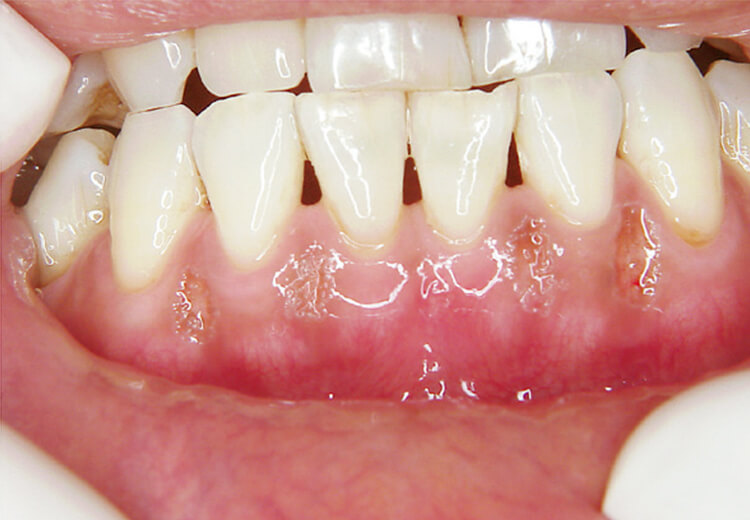
写真9 術中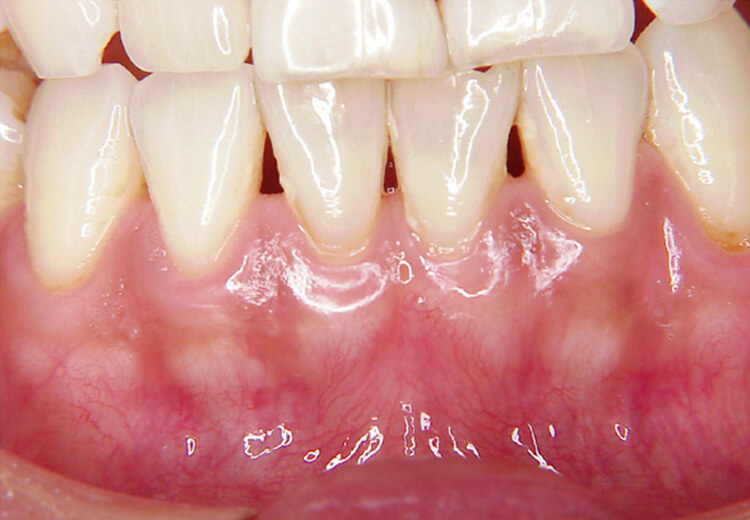
写真10 術後
また、臨床に入る前にこのような質問がありました。
「モリタは歯科用レーザーの開発は長いですか?」
<解答:モリタ製作所薬事管理部部長 岡上吉秀>
- 1972年-
 炭酸ガスレーザー伝送用のマニピュレーターの開発
炭酸ガスレーザー伝送用のマニピュレーターの開発
超鋼ミラー使用で動物実験(ラット歯牙に照射)
当時伝送が困難であった炭酸ガスレーザーの光をエアータービンの空気軸受けの材料である超硬ミラーを用いて作成したマニピュレーターを用いて評価実験を行った。
- 1975年-
 炭酸ガスレーザーにて動物実験(兎肝臓に照射)
炭酸ガスレーザーにて動物実験(兎肝臓に照射)
軟組織へ使用した際の止血に対する有効性は確認できたものの、硬組織組への照射は熱による歯質クラック発生の問題が発生した。
- 1978年-
 Nd:YAGレーザーにて耐酸性付与の研究開始
Nd:YAGレーザーにて耐酸性付与の研究開始
ノーマルパルス発振や、Qスイッチ発振のNd:YAGレーザーによる硬組織切削の可能性を検証する実験が行われたが、歯質への吸収特性はNd:YAGレーザーの場合、切削には不向きであることが判明し、研究の対象は耐酸性付与によるう蝕予防に移っていった。
- 1988年-
- Er:YAGレーザーによる歯科応用の研究開始
歯質の吸光特性はEr:YAGレーザーの波長では、特異的に歯質の中の水に吸収されている事実に基づき、歯科用のレーザーとしてEr:YAGレーザーを研究開発の第一優先目標にした。
- 1990年-
- Er:YAGレーザー臨床研究プロジェクト開始
大学との共同研究を開始した。ビーグル犬を用いた安全性確認の試験や非臨床試験を実施、学会にその成果を発表した。
- 1994年-
- Er:YAGレーザー臨床治験開始
4大学にて臨床治験を実施
- 1995年-
- Er:YAGレーザー薬事製造承認申請
- 1996年-
- Er:YAGレーザー(アーウィン)販売開始

- 1997年-
- Er:YAGレーザー新規適用症例の開発
Er:YAGレーザーの伝送手段としての中空導波路の研究を推進
同時に新システムの装置を用いて動物による安全性確認試験開始
- 1999年-
- 新型Er:YAGレーザー(アーウィンアドベール)
臨床治験開始 4大学5施設にて臨床治験開始
- 2001年-
- 新型Er:YAGレーザー(アーウィンアドベール)
薬事製造承認申請
- 2003年-
- 新型Er:YAGレーザー(アーウィンアドベール)
薬事製造承認
- 2004年-
- 発売開始
★前記のようにモリタ製作所におけるレーザーの臨床応用の研究の歴史は古く、30年以上前から大学との連携で研究を続けてきた。レーザーの歯科医療への応用研究の歴史は、始めにレーザーありきのシーズオリエンテッドそのものであった。
これは、当時レーザーを色々な波長で試すことができないという技術的な理由から、手に入るレーザーでの用途開発の歴史であった。
当時一般工業界でもポピュラーなレーザーといえば、炭酸ガスレーザーとNd:YAGレーザーであった。これは、その発振効率の良さから熱エネルギーそのものを使用する工業分野で盛んに利用された。
またその熱作用が生体軟組織の凝固、止血、蒸散、切開に有効であることから、一般医療の外科分野でレーザーメスとして普及してきた。
歯科用のレーザーの開発の歴史も、歯科の場合は対象が歯牙そのものの硬組織に向くのは当然であるが、アパタイトの蒸散温度は非常に高く、歯牙硬組織が蒸散するようなエネルギーを照射すれば、歯牙そのものや、近傍組織に大きな熱的な影響を及ぼすことから、硬組織用のレーザーは実用化が遅れていた。一般外科の延長として、歯科においても、軟組織に対するレーザーメスとして使用されてきた。現在歯科用として薬事承認されている炭酸ガスレーザーとNd:YAGレーザーは軟組織用のレーザーメスがほとんどである。
このようにシーズ志向から研究が進められた歯科用レーザーも、臨床現場のニーズが反映された波長のものへとシフトしてきた。
生体の大きな部分を占める水に特異的に吸収される光の波長は約3μmであるが、まさにEr:YAGレーザー(波長2.94μm)がその波長に合致している。
Er:YAGレーザーはハイドロキシアパタイトを結合しているSolidなH2OやHydration Shell(水和殻)の吸収のピークである波長3μm付近に近い波長であるため、歯質そのものに熱影響が発生する前にアパタイトの結合を解き、歯質を崩壊、ひいては切削ができるといわれている。その反面、極表面にしか作用が及ばないことで、軟組織切開の際の凝固作用が少なく、レーザーの特長である止血効果は他のレーザーに比べると低いが侵襲が深部に及ばず、早期の創面治癒には有利であるといわれている。
炭酸ガスレーザーも硬組織である歯牙にも吸収されるが、歯質のハイドロキシアパタイトのリン酸イオン基や炭酸カルシウムに吸収されるため、歯質の炭化や熱歪みによるクラックが発生する場合がある。
このように、一方では熱的な蒸散・凝固作用によるものと、直接的な熱作用でないもの。他方では表面吸収型のものと、深達型のものという分類ができる。生体組織との相互作用を考えるとき、熱的な蒸散・凝固作用で深達型のレーザーであるNd:YAGレーザーや半導体レーザーは、歯肉等の軟組織の切開、止血に有効である反面、レーザー光の散乱到達による隣接歯牙や歯槽骨への熱的影響に留意する必要がある。
また、一般外科でも長く用いられている炭酸ガスレーザーは熱的な蒸散・凝固作用と表面吸収型のレーザーであるが、その対象も前述の理由で軟組織に限定されている。
このように、レーザーの生体との相互作用を見極め、最適な波長のレーザーを選択して製品化することはモリタ製作所のレーザー開発の歴史であった。その結果、硬組織疾患、軟組織疾患、歯周疾患というように口腔内の多くの疾患に対応でできる波長として、Er:YAGレーザーを選択した。
臨床的には総論として、
「Er:YAGレーザーは歯周によく効くといわれますが、日常どのように応用していますか?」がありました。
歯周病は、細菌感染症の1つで、私たち歯科医は細菌(バイオフィルム)を如何に取り除くかを歯周治療の大前提として捉えています。
歯周病菌(バイオフィルム)の除去を目的として、スケーリング、ルートプレーニングまたは歯周外科を行い、細菌の徹底的な排除を行ってきました。これらの方法には物理的に細菌(バイオフィルム)の除去するために、手用スケーラー、超音波スケーラーなどを用いてきました。この方法はベーシックな方法で確実な成果を収めてきましたが、術者の経験や技術、治療期間の長期化などによる患者のモチベーションの低下などにより、なかなか思うような結果を期待することが困難でした。
また、この方法では細菌を口腔内から完全に除去することは不可能で細菌を再度、口腔内に撒き散らす結果となり、ある程度の減菌はできても殺菌を行うことは困難でした。
そして、歯周治療後には多くの軟組織を失い審美的にも満足な結果を残すことは、難しいことでした(図1~3)。
このように高度に進行した歯周病では軟組織の減少は目をつぶらなければなりませんが、審美的には不満を残す結果となることが多いです。
近年、歯周ポケット内の細菌を殺菌する目的でレーザーを使用する方法が試みられています。光学的なスケーリング(レーザースケーリング)は細菌の除去と同時に殺菌も行えるというメリットがあります。
それでは、どのようなレーザーが歯周ポケット内の細菌に有効であるのでしょうか。どのようなレーザーであれ、細菌に対して有効であるのは、周知の事実ですが、歯周ポケットという狭く、また根面や歯槽骨という硬組織に囲まれた特異な環境下に適した臨床的に有効なレーザーとはどの様なタイプのレーザーなのでしょうか。
今回、Er:YAGレーザー(アドベール)を用い、レーザースケーリングを行った結果、歯周治療的にも、審美的にも、良好な結果を得ることができたので報告します。
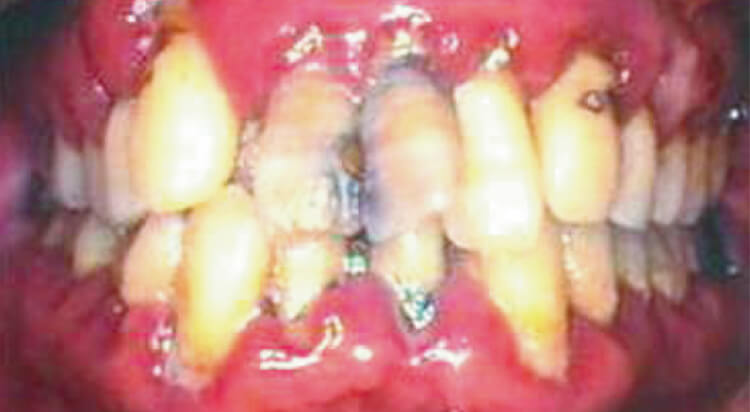
図1 全顎に高度の軟組織の炎症が存在しプラーク、歯石が多量に付着している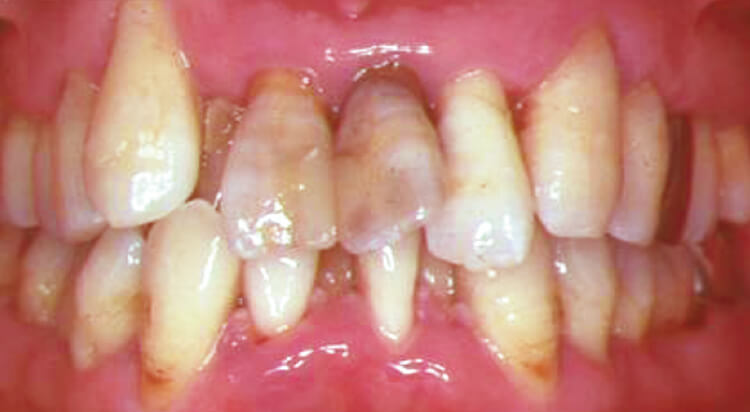
図2 初期治療終了後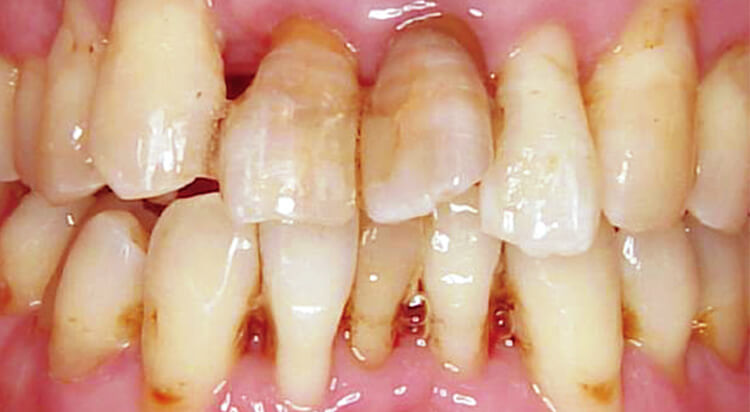
図3 メンテナンス
■Er:YAGレーザー(アドベール)によるスケーリングの症例
患者は62歳男性で、歯肉の腫れを主訴として来院。歯周検査の結果、全歯牙に4~8mmの歯周ポケットが存在しており、特に上顎左側犬歯遠心、上顎右側小臼歯口蓋部遠心は7~8mmのポケットが存在し、出血と排膿があります(図4~6)。
全顎にわたり歯周ポケット内にレーザーを照射を行い(図7、8)、歯冠部のプラークを除去後、すべての歯牙のポケットに対し80mJ 10ppsの出力で照射した後、出力40mJ10pps、ブラシ型のチップを用いて根面周囲のデプラドメントを行いました。
術後14日で、歯周組織は安定し出血、排膿はなく軟組織の退縮もほとんどありません(図9、10)。この状態でメンテナンスにはいりました。
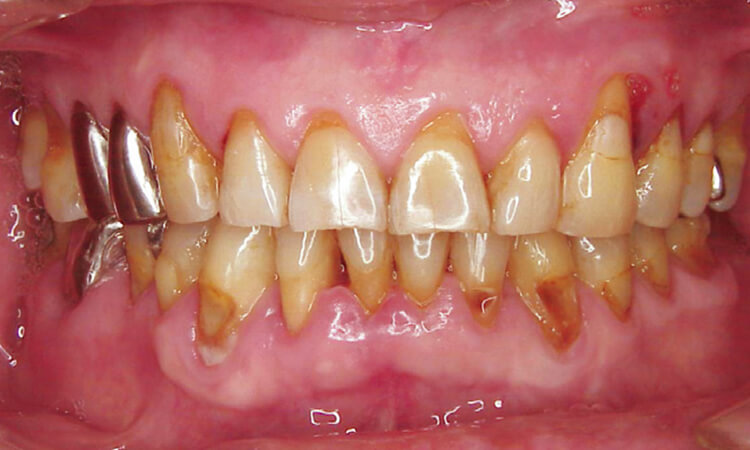
図4 治療前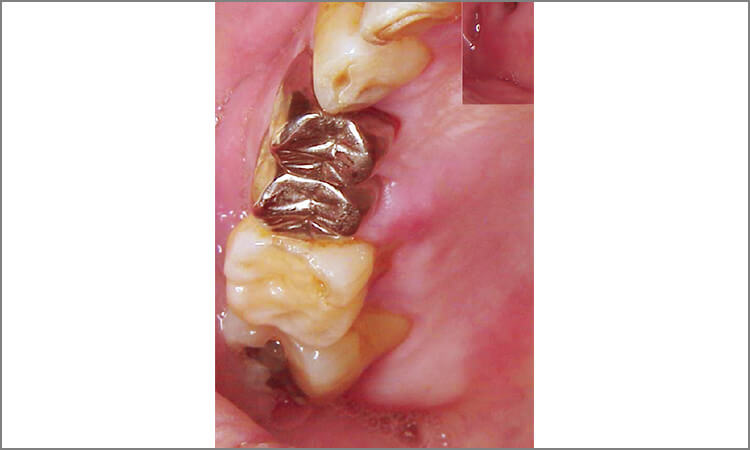
図5 口蓋の腫脹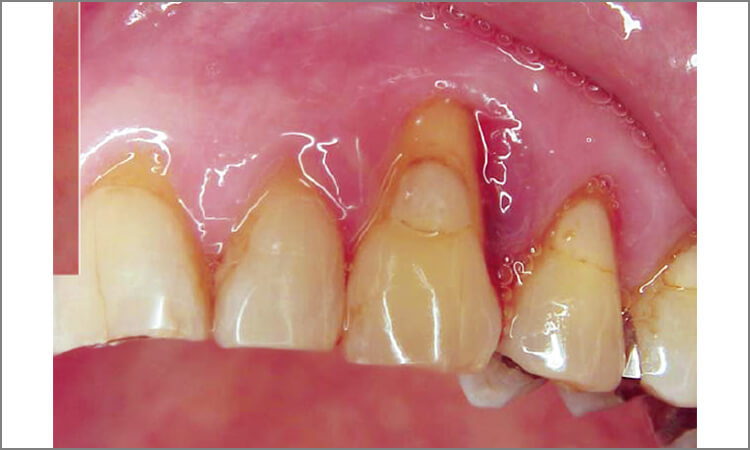
図6 上顎左側犬歯部 8mmのポケット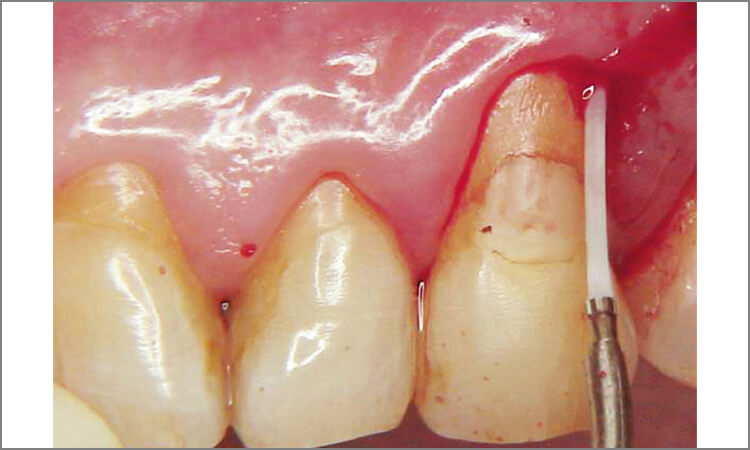
図7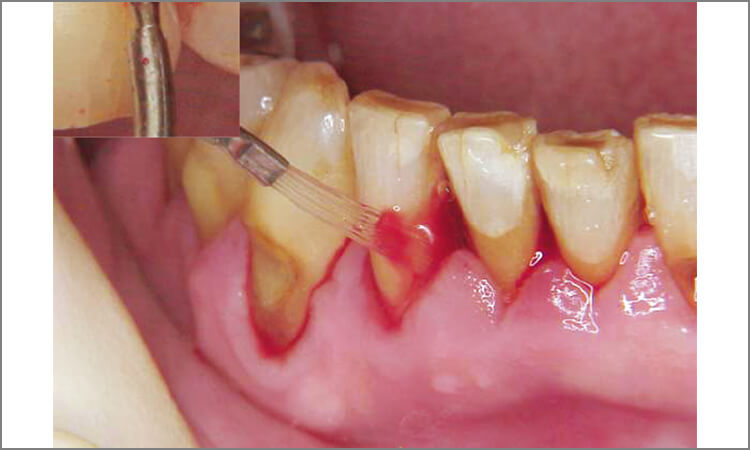
図8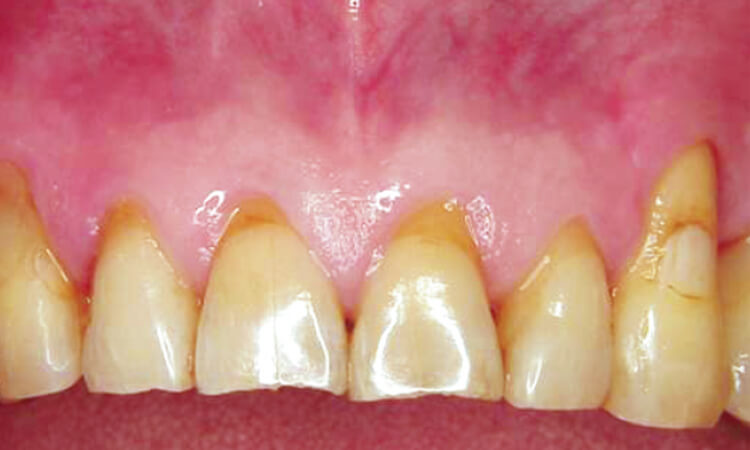
図9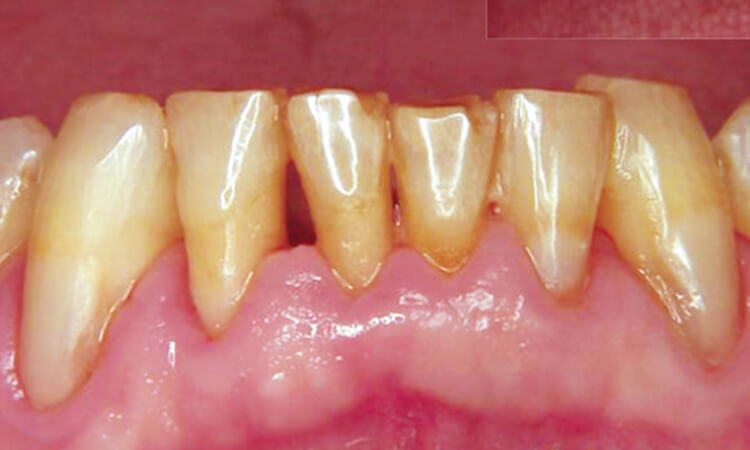
図10
全顎に及ぶ高度に進行した歯周組織の崩壊が進んでいるこのような症例では、部分的スケーリングやルートプレーニングでは対応が難しく、ある部位の処置を終わらせると別な部位から排膿や腫脹、というように、治療が症状の後追いとなり、症状の進行を止めることが困難です。
このような状態では、一回の処置で、できる限り口腔内の細菌量を減少させる必要がありますが、手用スケーラーや超音波スケーラーでの全顎にわたるSRPでは時間がかかり、また術中、術後の疼痛になやまされ、患者への負担が大きすぎます。
一方、Er:YAGレーザーによるスケーリングでは、振動や疼痛がなく、患者への負担が少なく、またチップがポケット底部まで到達しSRPが可能でさらに殺菌効果も期待できます。
Schwartzらによると通常のSRPより再付着が良好であると報告され、また根面や歯槽骨に対して熱的な損傷は少ないといわれています。
Er:YAGレーザー(アドベール)は歯周ポケットという歯牙、歯槽骨に囲まれた特異な環境下においての使用では優れたれ能力を発揮するレーザーであるといえます。
<解答:横須賀市開業 津久井 明先生>
1996年の春に発売され、当時臨床応用は右も左もわからない状況でしたが、やっと先が見えてきたような気がします。
今回は各論まで掲載することができませんでしたが、器械に対しての歴史・高パルスの可能性・歯周処置に対しての方向性を書かせて頂きました。
次回は硬組織・軟組織・歯周処置・インプラント関係・その他と各論での質問事項を検討して行きたいと考えています。
今後も各地方で、症例検討会は開かれると思いますので、ぜひ参加して頂き臨床での疑問・不明事項をなくし、明日からの臨床に応用して頂きたいと思います。アジアにおいての歯科治療にご興味のある先生がおられましたら、ご連絡ください。
同じ筆者の記事を探す【 篠木 毅 】
モリタ友の会会員限定記事
- 181号 Dental Talk Er:YAGレーザー発売25周年記念対談 Er:YAGレーザーの多彩な活用方法と将来展望
- 168号 Field Report 歯科診療の可能性を広げる 高画質の歯科用X線CT装置
- 166号 Clinical Report レーザー歯科医療における保険収載の潮流と安全性について
- 135号 CLINICAL REPORT 2波長のレーザーを利用した 光学的なカリエス治療の実際
- 130号 CLINICAL REPORT Er:YAGレーザーの再考 -程度大切-
同じテーマの記事を探す【 レーザー 】
モリタ友の会会員限定記事
- 179号 Clinical Report 歯周病患者におけるEr:YAGレーザーの日常臨床への導入 SPTを通じた歯科衛生士との連携
- 178号 Clinical Report 歯周病治療におけるEr:YAGレーザーの臨床的有用性
- 177号 Clinical Report Erwin AdvErL EVOの臨床応用の有用性と実際
- 176号 Clinical Report 日常臨床におけるEr: YAGレーザー
- 175号 Clinical Report Erwin AdvErL EVO を使用した口腔軟組織の切開、切除の実際
他の記事を探す
モリタ友の会
セミナー情報
会員登録した方のみ、
限定コンテンツ・サービスが無料で利用可能
オンラインカタログでの製品の価格チェックやすべての記事の閲覧、臨床や経営に役立つメールマガジンを受け取ることができます。
商品のモニター参加や、新製品・優良品のご提供、セミナー優待割引のある、もっとお得な有料会員サービスもあります。











 炭酸ガスレーザー伝送用のマニピュレーターの開発
炭酸ガスレーザー伝送用のマニピュレーターの開発 炭酸ガスレーザーにて動物実験(兎肝臓に照射)
炭酸ガスレーザーにて動物実験(兎肝臓に照射) Nd:YAGレーザーにて耐酸性付与の研究開始
Nd:YAGレーザーにて耐酸性付与の研究開始

















