153号 SUMMER 目次を見る
目 次
はじめに
天然歯を保つことは歯科医師の使命である。ではどのようにすれば、できるだけ多くの天然歯を残すことができるのだろうか?
幸いなことに、21世紀になってmineral trioxideaggregate(MTA)と呼ばれる新しい材料が歯科医療に導入された。その化学的基盤は、水硬性ケイ酸カルシウムであり、封鎖性、抗菌作用、生物学的活性という3つの特徴を備えている。これらの特徴は天然歯を温存するために必須である。MTAは髄腔や根管の内外で細菌の侵入を完全に阻止する一方で、ある程度象牙細管内を殺菌して、損なわれた歯牙と歯周組織を再生することができる。
我々がMTAの研究・開発に注力し始めて10年が経過し、2013年12月1日にはMTAフォーラムが開催され、10周年を祝した。10年の旅を記す今、天然歯を温存するという努力が歯科医師の先生方と患者さん達に幸福をもたらしてくれるように祈念する。
水酸化カルシウム<Ca(OH)2>とMTAの違い
硬化したMTAは不溶性ケイ酸カルシウム水和物(CSH)と、少しは溶けるCa(OH)2から構成されており、200μ厚のMTAの表層1)は、Ca(OH)2が体液からでるリン酸塩イオンと反応しCDHA(calcium deficient hydroxy apatite)ができるか、炭酸飽和血と反応してCACO3(Calcite)ができることによって生成されている(図1)。フィブロネクチンはセメント芽細胞2、3)または骨芽細胞に付着し、硬組織及び象牙芽細胞様の細胞を、歯質に形成し、これが三次象牙質(デンティン・ブリッジ)になる4〜9)。最初MTAは高アルカリ性だが、その後体液中で中和される10〜13)。しかし、純粋なCa(OH)2の粉末の練和物は硬化することなく、Ca(OH)2粒子は最終的に炎症反応中に体液中に溶解し、スペースを作ってしまう。これでは封鎖性を達成することはできないばかりか、長期間アルカリ性が維持されると当該歯牙は弱体化する可能性がある。
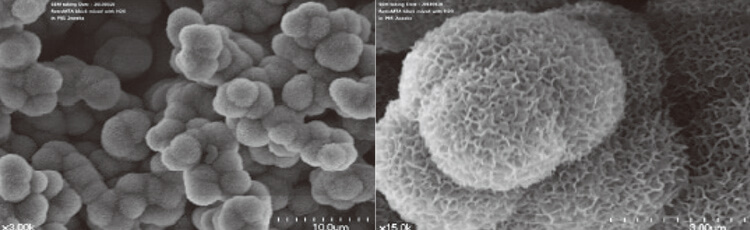
図1 RetroMTAが体液のリン酸塩イオンと反応して、表面にハイドロキシアパタイトが生成されている(拡大率 左:3000倍、右:15000倍)。
ベース材
1. 深い窩洞のベース材
深いう蝕歯14、15)のベース材として用いる時の、速硬性MTAの利点は以下の通りである。
(1)知覚過敏歯への熱伝導を妨げ、緩和作用をもたらす。 (2)最初の界面封鎖効果(図2)/最終の界面の封鎖効果(図3) (3)遮蔽と石灰化の効果16〜18) (4)三次象牙質(デンティン・ブリッジ)形成の効果(図4)
MTAは特殊な熱伝導材料で、温度刺激を避けることができる。最初の界面部封鎖は物理的に達成されるが、経時的に化学的封鎖に変わる。したがって象牙質壁とMTAの界面部封鎖は化学的なものであり19〜22)、この時の化学結合には高アルカリ性が必要である。
最初に多量の高アルカリ性(pH=12.5)のCa(OH)2で界面を封鎖することによって象牙質表面のバイオミネラリゼーション23〜25)が可能となる(図5)。
2. 変色防止のためのベース材
MTAの造影剤として用いられるBi2O3によって起こる変色は、変色した古い材料をCEJ下3mmまで機械的に除去し、バイオセラミックスの厚いベース材を塗布することで修復できる。この処置の目的は封鎖性と変色の防止である(図6)。
3. 使用方法
使用方法は、まず最初に、粉末に液を3滴加えて混和し、約20秒後、表面の光沢が失われたら、覆髄すべき部分に、材料を適切なインスツルメントを用いて充填する。初期硬化する3分後には、高速バーで窩洞形成が行える(図7)。
最終の修復治療は、ベース材を塗布した当日に行うこともできるが、仮封セメントを塗布し、次回の治療日に窩洞形成をした後に行うことも可能である(図8)。

図2 最初の界面部封鎖効果:界面部とグラス・アイオノマー・コアが化学的封鎖を呈する一方で、象牙質壁と窩底の界面部は物理的封鎖となっている。
図3 最終の界面部封鎖効果:象牙質壁とMTAの界面部の間に完全な化学的封鎖が存在する。
図4 経時的に象牙細管中の細菌増殖が増加していくが、ハイドロキシアパタイト(左)と不溶性CSH(右)の形成によって増殖は根絶される。この現象は最初のpH12.5という高アルカリ性反応によってのみ可能である。それは高アルカリ性から、のちに中性に変わる。
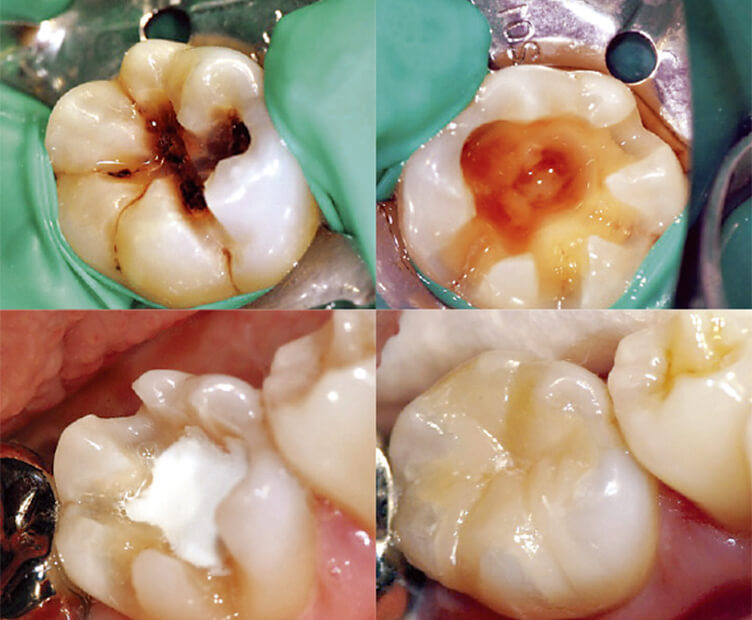
図5 カリエスを除去すると、深い窩洞が見えた(左上、右上)。1.5mm厚の速硬性BioMTAのベース材を塗布すると(左下)、最初は物理的な封鎖、のちには化学的な封鎖が達成される。レジン・インレーで最終の修復治療を行った(右下)。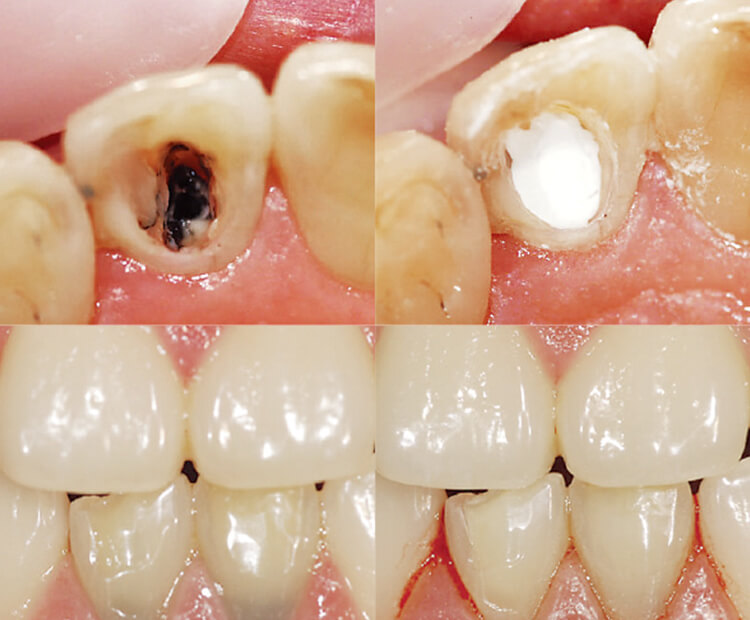
図6 封鎖性と変色防止のために厚いベース材を塗布する。左上:変色した充填材料(暗く変色)。右上:バイオセラミックスで充填後の状態。左下:歯頸部の変色(唇側面観)。右下:バイオセラミックスで充填後(唇側面観)。
図7 混和後(左上)、表面の光沢が失われた状態(右上)、充填直後(左下)。3分後には高速バーで窩洞形成が可能(右下)。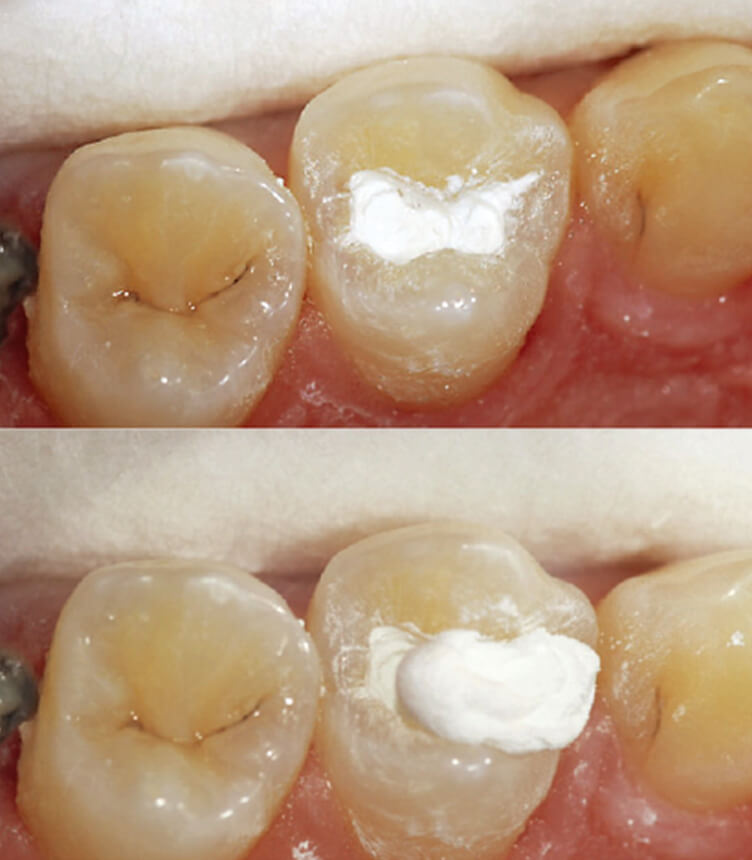
図8 最終修復治療はベース材塗布の当日あるいは窩洞形成後に行うことが可能。
直接覆髄
Ca(OH)2は硬化せず溶解して、トンネル状欠損ができ、この空隙を通して細菌が侵入することがあり、続いて歯髄の炎症が起こる。MTAの場合、硬化後は不溶性となり、細菌の侵入を防ぐ。CDHA(calcium deficient hydroxyl patite)も高アルカリ性表面において形成され、経時的に封鎖性が増し、化学的封鎖を達成する。高アルカリ性は局所に存在する細菌に対して抗菌作用を発揮し、三次(修復)象牙質の形成を誘導し、その後、アルカリ性は経時的に徐々に中和されていく。
直接覆髄の処置中に考慮すべき点として、組織液が存在すると、接触面上のMTAは硬化しないので、以下を留意すべきである。
(1)少なくとも1.5mm厚の覆髄層(capping layer)を形成すべきである。 (2)覆髄層(capping layer)の維持のために、機械的維持形態を付与すべきである。 (3)速硬性のMTAを使用すべきである。 (4)MTAは変色を起こすべきではない(図9)。 (5)MTAは白色でなくてはならない。
通常、MTAを前歯の直接覆髄に用いると、変色するか、灰色がエナメル質を通して見えてしまうので、変色しないMTAを用いるべきである。さらに覆髄層(capping layer)の十分な厚みと機械的維持が必要である。直接覆髄の処置をした日に最終の修復治療
をする場合は、冷感テストと打診によってチェックすべきである。
生物学的封鎖効果は豊富に存在する。高アルカリ性Ca(OH)2が最初に界面部の封鎖をすることで達成され、それが三次象牙質(デンティン・ブリッジ)の形成を誘導し、徐々にぶ厚くなってゆく(図10)。
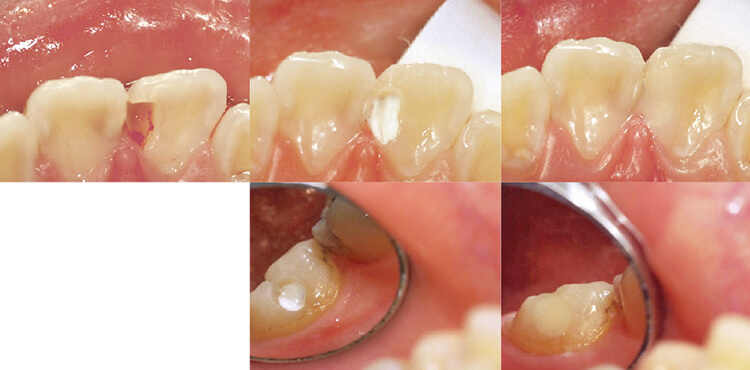
図9 直接覆髄の場合には、白色で変色しないMTAを使用する。
上顎左側中切歯舌側近心部への修復症例(左上、中上、右上)。下顎左側第一大臼歯頰側面への修復症例(中下、右下)。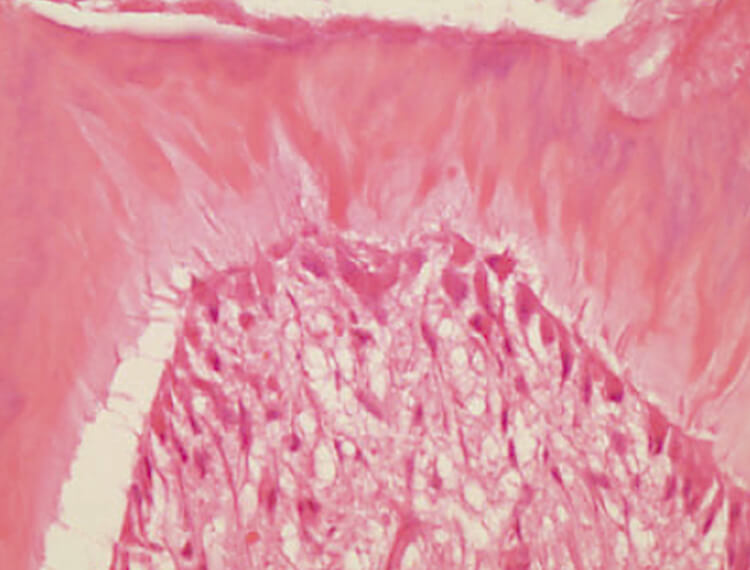
図10 生物学的封鎖効果は豊富に存在する。
生活歯断髄(切断)
ホルムクレゾール(FC)は、過去60年間臨床使用されてきたが、遺伝子毒性があり、発がん性材料として分類されている26〜28)。OSHA(米国労働安全衛生庁)は遺伝子毒性について警告を発している。ACGH(TheAmerican Conference of overnmental Hygienists)は、歯科医院のような閉鎖された場所での同材料の使用は0.3ppm未満に抑えるように規制している。JSOH(日本産業衛生学会)は作業領域では0.5ppmまで許容しているが、WHOの屋内濃度水準は0.08ppmまでとなっている。IARC(国際がん研究機関)はFCを「グループ1:人に対する発がん性あり」と分類している。研究によると、FCによる生活歯断髄を行っている医療スタッフは、排気装置なしでは処置1回あたり0.04〜0.24ppmの用量に暴露される。FCを即座に排除することが難しいならば、戸外に排出するための排気装置を使用すべきである。
MTAは為害作用が指摘されているFCの代わりに生活歯髄切断に用いることが可能である(図11)。メタ分析によると、乳歯の場合は、MTAの方がFCより成功率が高く、吸収の可能性も低いと報告されている。MTA塗布後、歯髄腔の閉塞部(PCO:pulp canal obliteration)内に象牙芽細胞様細胞が存在するため、歯髄の生活度は維持される。
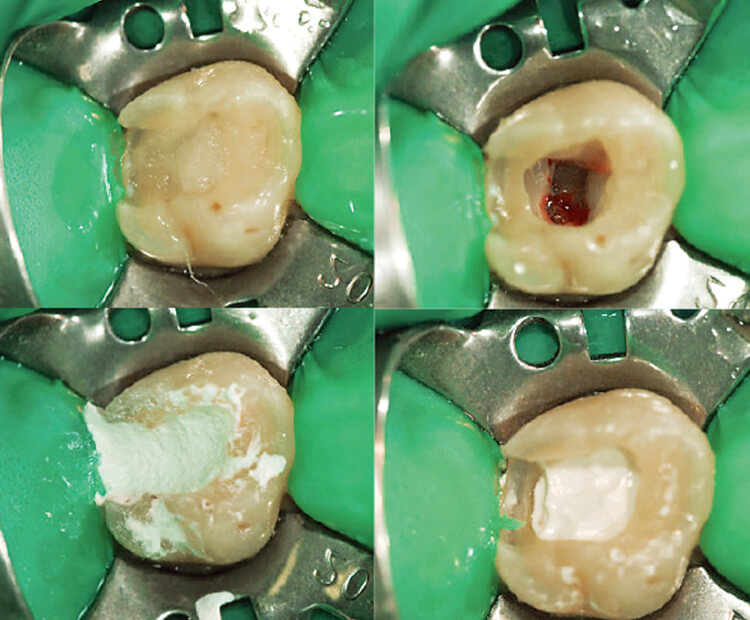
図11 NaOClによる止血後、バイオセラミックスをベース材として分厚く塗布した。3分後高速ダイヤモンドバーで窩洞形成を行い、レジン・コアの作製を同日に行った。
pH
生活歯断髄の場合、MTAのpHは高くなくてはならないのか?あるいはpHは中性であるべきなのか?臨床的効果を得るためには、抗菌作用と組織再生能を有する高アルカリ性MTAを使用することが望ましい。
韓国内外の大半の研究者の意見は、以下のように要約できる29〜41)。
(1)Ca(OH)2の放出量が多いほどpH値は高くなる。 (2)Ca(OH)2の放出はCDHA(calcium deficient hydroxyl apatite)の形成を誘発し、封鎖性を増強する。 (3)最初の抗菌効果は高アルカリ性によるものである。E.faecalisはpH=12の環境に1時間暴露されると根絶する。 (4)破骨細胞が放出する乳酸は中和をもたらし、硬組織の溶解を防止する。 (5)ALP(アルカリ・ホスフォターゼ)の活性化は硬組織の形成を促す。 (6)内毒素の不活化。 (7)象牙細管に浸潤したCa(OH)2は外部吸収の進行を阻止し、治癒を助ける。
高アルカリ性MTAの抗菌作用と封鎖性では、E.faecalisへの抗菌作用を発揮するには混和後pH=12.5に到達しなくてはならない。さらに、象牙質との界面部の封鎖性も高アルカリ性によるもので、高アルカリ性がバイオミネラリゼーションを誘発し、その結
果CDHA(calcium deficient hydroxyl apatite)が形成される。この種の封鎖性は0μ接触または化学結合による封鎖性として知られている。
深い窩洞にバイオセラミックスをベース材として用いる時、窩壁によって化学結合が達成される(in-vitro 図12)。MTAが、重度の感染根管の生物学的充填のために用いられると、根管系の壁面によって化学結合が達成される(in-vitro)。よって、これらの現象は、混和後の最初の高アルカリ性によるバイオミネラリゼーションの結果である。その後ゆっくりと中和されpH=7に近づく。

図12 深い窩洞にBioMTAをベース材として用いる時、窩壁によって化学結合が達成される。
小児歯科への応用
小児歯科において一般的に行われる歯髄治療の種類は、直接覆髄、断髄(apexogenesisとも言われる)と、未完成な永久歯の歯根形成促進法(アペキシフィケーション)、並びに乳歯の断髄と抜髄である。このような歯髄治療の材料として、Ca(OH)2 は主として未完成永久歯に使用され、従来乳歯にはFCと硫酸鉄が用いられてきた。
最近、MTAが徐々にこれらの材料に取ってかわりつつあるが、ここで簡単に小児歯科におけるMTAの使用を紹介する。MTAは主として、未完成永久歯において、損傷または歯牙う蝕によって露出した歯髄から炎症、出血部位を除去した後に、健全な歯髄を直接覆髄するために用いられる。このような場合、一般には水酸化カルシウムが用いられるが、時には吸収などの理由で効果がないこともある。
昨今、MTAの使用について成功症例や臨床的結果が報告されており、その成功率はかなり高い。多数の臨床研究が、乳歯の断髄におけるMTAの使用はFCと類似した、またはそれより優れた結果を報告している。
従来の断髄では、歯髄切断後に出血をコントロールし、それからFCや硫酸鉄のような薬剤で処理をして、局所を酸化亜鉛ユージノールで被覆していた。しかしMTAでは薬剤治療は不要であり、出血をチェックした後、MTAを直接覆髄し、局所を湿らせたコットンか酸化亜鉛ユージノールで仮封し、次回の治療時、局所にコアとクラウンを装着する。即硬性MTAが開発されたおかげで、MTAはわずか数分で硬化し、即座に次のステップに移ることができるようになった。
小児歯科において、MTAはより良い機能(即硬性、変色なしなど)で普及を加速化しているが、何よりもまず適切な診断、適応を明確に理解することが治療成功の前提になるということを忘れてはならない。
- 1) GANDOLFI, Maria Giovanna, et al. Kinetics of apatite formation on a calcium-silicate cement for rootend filling during ageing in physiological-like phosphate solutions. Clinical oral nvestigations,2010, 14.6: 659-668.
- 2) THOMSON, Troy S., et al. Cementoblasts maintain expression of osteocalcin in the presence of mineral trioxide aggregate. Journal of Endodontics, 2003,29.6: 407-412.
- 3) HAKKI, Sema S., et al. Effects of mineral trioxide aggregate on cell survival, gene expression associated with mineralized tissues, and biomineralization of cementoblasts. Journal of endodontics, 2009,35.4: 513-519.
- 4) FARACO, Italo Medeiros; HOLLAND, Roberto. Response of the pulp of dogs to capping with mineral trioxide aggregate or a calcium hydroxide cement.Dental Traumatology, 2001, 17.4: 163-166.
- 5) ACCORINTE, M. L. R., et al. Response of human dental pulp capped with MTA and calcium hydroxide powder. Operative dentistry, 2008, 33.5: 488-495.
- 6) HOLLAND, Roberto, et al. Healing process of dog dental pulp after pulpotomy and pulp covering with mineral trioxide aggregate or Portland cement. Braz Dent J, 2001, 12.2: 109-13.
- 7) BERNABÉ, Pedro Felício Estrada, et al. Comparative study of MTA and other materials in retrofilling of pulpless dogs' teeth. Brazilian dental journal,2005, 16.2: 149-155.
- 8) HOLLAND, Roberto, et al. Reaction of dogs' teeth to root canal filling with mineral trioxide aggregate or a glass ionomer sealer. Journal of endodontics,1999, 25.11: 728-730.
- 9) HOLLAND, Roberto, et al. Mineral trioxide aggregate repair of lateral root perforations. Journal of endodontics,2001, 27.4: 281-284.
- 10) CAMILLERI, J., et al. Dynamic sealing ability of MTA root canal sealer. International endodontic journal,2011, 44.1: 9-20.
- 11) RICH, A., et al. dynamic sealing ability of mta root canal sealer. International Endodontic Journal, 2010.
- 12) Duarte MA, Demarchi AC, Yamashita JC, Kuga MC, Fraga Sde C. pH and calcium ion release of 2 root-end filling materials. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003; 95(3):345–7.
- 13) Tanomaru-Filho, M., Chaves Faleiros, F. B., Saçaki,J. N., Hungaro Duarte, M. A., & Guerreiro-Tanomaru,J. M. (2009). Evaluation of pH and calcium ion release of root-end filling materials containing calcium hydroxide or mineral trioxide aggregate. Journal of endodontics,35(10), 1418-1421.
- 14) GRUYTHUYSEN, René; VAN STRIJP, Guus; WU,Min-Kai. Long-term survival of indirect pulp treatment performed in primary and permanent teeth with clinically diagnosed deep carious QI, Yi-pin, et al. Remineralization of artificial dentinal caries lesions by biomimetically modified mineral trioxide aggregate.Acta biomaterialia, 2012, 8.2: 836-842.lesions. Journal of endodontics, 2010, 36.9: 1490-1493.
- 15) HOLLAND, Roberto, et al. Reaction of rat connective tissue to implanted dentin tubes filled with mineral trioxide aggregate or calcium hydroxide. Journal of Endodontics, 1999, 25.3: 161-166.
- 16) YOO, Jun Sang, et al. Bacterial entombment by intratubular mineralization following orthograde mineral trioxide aggregate obturation: a scanning electron microscopy study. International journal of oral science, 2014.
- 17) BOGEN, George; KUTTLER, Sergio. Mineral trioxide aggregate obturation: a review and case series.Journal of endodontics, 2009, 35.6: 777-790.
- 18) DESAI, Shalin; CHANDLER, Nicholas. Calcium Hydroxide–Based Root Canal Sealers: A Review. Journal of endodontics, 2009, 35.4: 475-480.
- 19) YILDIRIM, Tahsin, et al. Effect of smear layer and root-end cavity thickness on apical sealing ability of MTA as a root-end filling material: a bacterial leakage study. Oral Surgery, Oral Medicine, Oral Pathology,Oral Radiology, and Endodontology, 2010, 109.1:e67-e72.
- 20) YILDIRIM, Tahsin; ORUÇOĞLU, Hasan; ÇOBANKARA,Funda Kont. Long-term evaluation of the influence of smear layer on the apical sealing ability of MTA. Journal of endodontics, 2008, 34.12: 1537-1540.
- 21) YILDIRIM, Tahsin, et al. Effect of smear layer and root-end cavity thickness on apical sealing ability of MTA as a root-end filling material: a bacterial leakage study. Oral Surgery, Oral Medicine, Oral Pathology,Oral Radiology, and Endodontology, 2010, 109.1:e67-e72.
- 22) TORABINEJAD, Mahmoud; PARIROKH, Masoud.Mineral trioxide aggregate: a comprehensive literature review̶part II: leakage and biocompatibility investigations.Journal of endodontics, 2010, 36.2:190-202.
- 23) REYES-CARMONA, Jessie F.; FELIPPE, Mara S.;FELIPPE, Wilson T. The biomineralization ability of mineral trioxide aggregate and Portland cement on dentin enhances the push-out strength. Journal of endodontics, 2010, 36.2: 286-291.
- 24) QI, Yi-pin, et al. Remineralization of artificial dentinal caries lesions by biomimetically modified mineral trioxide aggregate. Acta biomaterialia, 2012, 8.2:836-842.
- 25) CHANG, Seok-Woo. Chemical characteristics of mineral trioxide aggregate and its hydration reaction.Restorative dentistry & endodontics, 2012, 37.4:188-193.
- 26) LEWIS, B. B.; CHESTNER, S. B. Formaldehyde in dentistry: a review of mutagenic and carcinogenic potential.Journal of the American Dental Association (1939), 1981, 103.3: 429-434.
- 27) MILNES, Alan R. Persuasive evidence that formocresol use in pediatric dentistry is safe. Journal-Canadian Dental Association, 2006, 72.3: 247.
- 28) ATHANASSIADIS, B., et al. A review of the effects of formaldehyde release from endodontic materials.International endodontic journal, 2014.
- 29) FAVA, L. R. G.; SAUNDERS, W. P. Calcium hydroxide pastes: classification and clinical indications. International endodontic journal,1999, 32.4: 257-282.
- 30) DESAI, Shalin; CHANDLER, Nicholas. Calcium Hydroxide–Based Root Canal Sealers: A Review. Journal of endodontics, 2009, 35.4: 475-480
- 31) Cvek M. Treatment of non-vital permanent incisors with calcium hydroxide. Odont Revy 1974;25:239.
- 32) Bystrom A, Claesson R, Sundqvist G. The antimicrobial effect of camphorated paramonochlorophenol,
- 33) camphorated phenol and calcium hydroxide in treatment of infected root canals. Endod Dent Traumatol 1985;1:170–5.
- 34) Manhart M. The calcium hydroxide method of endodontic sealing. Oral Surg Oral Med Oral Pathol 1982;54:219–24.
- 35) Stock C. Calcium hydroxide: root resorption and perio-endo lesions. Br Dent J 1985;158:325–34.
- 36) Torneck C, Moe H, Howley T. The effect of calcium hydroxide on porcine pulp fibroblasts in vitro.Tronstad L, Andreason J, Hasselgren G, et al. pH changes in dental tissues after root
- 37) Canal filling with calcium hydroxide. J Endod 1981;7:17–21.) J Endod 1983;9:131–6.
- 38) MCHUGH, Christopher P., et al. pH Required to Kill< i> Enterococcus faecalis</i> in Vitro. Journal of endodontics, 2004, 30.4: 218-219. (Ph)
- 39) TANOMARU-FILHO, Mário, et al. In vitro antimicrobial activity of endodontic sealers, MTA-based cements and Portland cement. Journal of Oral Science,2007, 49.1: 41-45.
- 40) MCHUGH, Christopher P., et al. pH Required to Kill Enterococcus faecalis in Vitro. Journal of endodontics,2004, 30.4: 218-219.
- 41) Estrela C, Estrela CR, Bammann LL, Pecora JD.Two methods to evaluate the antimicrobial action of calcium hydroxide pates J Endodon 2001;27:720–3
目 次
モリタ友の会会員限定記事
- Dental Talk Special 審美修復治療の新たなる展開 審美修復治療の動向とマテリアルの最新トレンド
- Trends Special 新しいレジン強化型グラスアイオノマーセメント「アドシールド® RM」について
- Trends Make Teeth Alive
- Clinical Report 前歯部直接覆髄が変わる BioMTA セメントが変える
- Trends 歯科用分離材「ウォッシャブルセップ」 ~口腔内で使用できる水溶性の分離材~
- Clinical Report 日常臨床に接着を活かす ―根管治療への接着の応用―
- Clinical Report 剥離子TM Sinus Lift Kit®を用いた低侵襲・経歯槽頂上顎洞挙上手術法 ~盲目的手術を解消するためには~
- Clinical Report 即時荷重におけるオステルISQ アナライザの有効利用
- Field Report 診断機能にとどまらないより効率良く精確な治療を実現するための支援ツール
- Technical Report カタナチタンアバットメントを用いた臨床的メリット ―カタナチタンアバットメント模型送付によるオーダー手順―
- Clinical Hint 歯科衛生士ができるお口の健康づくりシリーズその3「機能性ガム」と「オーラルアプライアンス」の歯科活用
他の記事を探す
モリタ友の会
セミナー情報
会員登録した方のみ、
限定コンテンツ・サービスが無料で利用可能
オンラインカタログでの製品の価格チェックやすべての記事の閲覧、臨床や経営に役立つメールマガジンを受け取ることができます。
商品のモニター参加や、新製品・優良品のご提供、セミナー優待割引のある、もっとお得な有料会員サービスもあります。



















